La Food and Drug Administration (FDA) des États-Unis a approuvé la transmission unidirectionnelle de données numériques pendant la prise en charge des patients avec la console automatisée Impella d’Abiomed (NASDAQ : ABMD), la console externe utilisée avec les pompes cardiaques Impella. La transmission de données est facilitée par l’interface Impella Connect, une plateforme de surveillance à distance dans le cloud conforme à la loi HIPAA qui est actuellement installée dans plus de 200 hôpitaux. Cette approbation signifie que les données de la console pourraient être diffusées en direct via Impella Connect vers un serveur sécurisé, où une intelligence artificielle (IA) pourrait offrir des prédictions cliniques au médecin du patient.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20200716005371/fr/
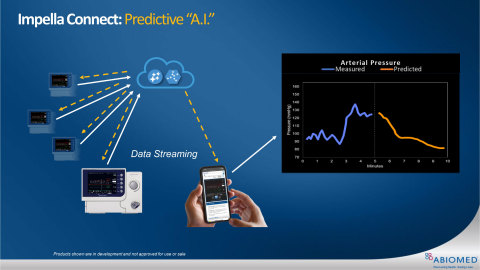
Figure 2 (Photo: Business Wire)
Afin d’illustrer la manière dont cette technologie pourrait être utilisée à l’avenir dans la pratique clinique, Abiomed a déjà développé un algorithme d’IA capable de prédire la pression artérielle d’un patient dans les cinq minutes à venir en se basant uniquement sur les cinq minutes précédentes, renseignées par les données de la console (voir Figure 1). Abiomed a également développé des algorithmes d’IA pour prédire d’autres paramètres, tels que le volume d’éjection systolique, la pression ventriculaire gauche et le débit cardiaque. L’utilisation de ces algorithmes d’IA n’est pas encore autorisée ou approuvée chez les patients. Lorsqu’ils seront entièrement développés, ils seront soumis à un examen réglementaire.
L’analyse prédictive est possible grâce à l’intégration des données des études cliniques Impella aux données de la console Impella, couvrant des milliers de cas, et à l’apprentissage des réseaux d’intelligence artificielle sur la base des données co-enregistrées. Les réseaux d’IA pourraient alors recevoir et analyser les données des consoles en temps réel puis envoyer des prévisions personnalisées au médecin du patient concerné (voir Figure 2).
« Les réseaux d’intelligence artificielle, dont l’apprentissage a été correctement réalisé en se basant sur la transmission de grands volumes de données, peuvent être des outils très puissants pour aider à la prise de décision clinique », a déclaré Chuck Simonton, docteur en médecine, médecin-chef d’Abiomed. « Un jour, grâce à l’intelligence artificielle, les médecins pourront peut-être prédire avec confiance l’hémodynamique future d’un patient. Cela rendrait la prise de décision clinique plus efficace et améliorerait le pronostic des patients. »
Abiomed étudie également l’intelligence artificielle afin de faire des prédictions plus holistiques, comme la probabilité qu’un patient retrouve sa fonction cardiaque native. Ces informations pourraient aider les professionnels de la santé à déterminer si un autre plan d’action s’avère nécessaire.
De plus amples informations sur l’orientation future de la technologie Impella, y compris sur l’application de l’intelligence artificielle, sont disponibles sur cette présentation en ligne.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d’une approbation avant commercialisation de la FDA américaine pour le traitement de certains patients atteints d’insuffisance cardiaque avancée qui subissent des interventions coronaires percutanées (ICP) électives et urgentes, telles que l’angioplastie par pose de stent ou de ballonnet, afin de rouvrir les artères coronaires obstruées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5® avec SmartAssist® sont des pompes cardiaques approuvées par la FDA américaine, utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles possèdent la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés. Le dispositif Impella RP® est approuvé par la FDA américaine pour traiter l’insuffisance ventriculaire droite ou une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque ou une opération à cœur ouvert. L’utilisation en urgence de la pompe Impella RP par du personnel soignant en milieu hospitalier est également permise afin de fournir une assistance ventriculaire droite temporaire pour une période allant jusqu’à 14 jours chez des patients en soins intensifs ayant une surface corporelle ≥ 1,5 m2, pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées au Covid-19, y compris l’embolie pulmonaire. La pompe Impella RP n’a été ni autorisée ni approuvée pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées au Covid-19. L’utilisation de la pompe Impella RP a été autorisée par la FDA pour les cas d’urgence mentionnés ci-dessus, en vertu d’une autorisation d’utilisation d’urgence (EUA), et a été autorisée uniquement tant que la déclaration de l’existence de circonstances justifie l’autorisation d’utilisation d’urgence de dispositifs médicaux en vertu de la section 564(b)(1) de la loi, 21 U.S.C. § 360bbb-3(b)(1), à moins que l’autorisation ne soit résiliée ou révoquée plus tôt.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients ICP à risque élevé et des patients AMI en état de choc cardiogénique pendant un maximum de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 10 jours. La pompe Impella 5.5 avec SmartAssist est certifiée CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 30 jours. La pompe Impella RP® est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou d’une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une opération à cœur ouvert ou une arythmie ventriculaire réfractaire. Pour en savoir plus sur le portefeuille de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes en matière de sécurité et de risque associées à l’utilisation de ces dispositifs, rendez-vous sur www.impella.com.
À PROPOS D’ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un fournisseur de premier plan de dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en effectuant le pompage du cœur. Pour plus d’informations, veuillez consulter : www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist et Impella Connect sont des marques déposées d’Abiomed, Inc., et sont enregistrées aux États-Unis ainsi que dans certains autres pays. Impella BTR, Impella ECP, CVAD Study et STEMI DTU Study sont des marques commerciales d’Abiomed, Inc., en attente de dépôt.
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les occasions futures et les approbations réglementaires prévues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées à la portée, l’ampleur et la durée de la pandémie de COVID-19, au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux dans le futur et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et difficultés détaillés dans les documents déposés par la société auprès de la Securities and Exchange Commission, notamment le dernier rapport annuel déposé (formulaire 10-K) ainsi que les documents déposés ou présentés par la suite auprès de la SEC. Les lecteurs sont priés de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourrait être faite afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20200716005371/fr/
